您现在的位置: 首页 > 科研教学 > 国家药物临床试验机构
2017-07-27 阅读量:
文件版本 | 第一版 | ||
文件编码 | YKYZXWKYY-JG-ZD-014-01 | ||
制定人 | 高昕 | 日期 | 2014.8.20 |
审核人 | 马继光 | 日期 | 2015.1.10 |
批准人 | 祁佐良 | 日期 | 2015.1.20 |
发布日期 | 2015.2.27 | 生效日期 | 2015.2.27 |
修订登记
编号 | 页码 | 修订内容 | 修订原因 及依据 | 修订人 签名/日期 | 批准人 签名/日期 |
审查登记
审查日期 | 签名 | 审查日期 | 签名 |
1.目的:
为使试验药物供应充分、保管妥善、应用正确和储存安全。
2.适用范围:
所有在本院承担的药物临床试验。
责任人:
4.依据:
《药物临床试验质量管理规范》(GCP)
《新药研究技术》
5.内容:
5.1管理制度。
5.1.1试验用药物按要求存放于临床试验用药房,并存放于带锁的药物柜或药物冰箱内。
5.1.2试验用药物仅供临床试验专用,不得销售或转送,不得使用于非受试者。
5.1.3试验用药物实行专人、专柜、专帐管理;试验药房钥匙、药物柜钥匙必须统一由专人保管。
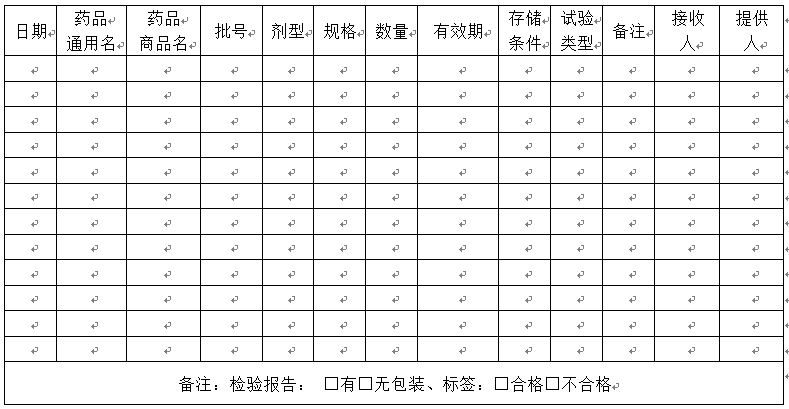
5.1.4接收申办方提供的试验用药物时应该检查:是否与药物临床试验批件相符,是否与药品检验报告上的批号一致,应急信封是否完整、无破损,包装箱内的药物是否与发送单上描述一致,有无缺损,数量是否正确,运送保存是否得当等。
生物等效性试验及人体生物利用度试验的试验用药品应留样。申办者提供给临床试验机构和研究者足够数量的试验用药品,临床试验机构和研究者随机抽取用于临床试验的药物和留存样品,留存样品与试验用药品应为同一批次。留存药品数量应满足进行五次按质量标准全检的要求。申办者应委托临床试验机构保存试验用药品留样至药品上市后至少2年。无适当保存条件的机构可将留存样品委托符合条件的独立的第三方保存,但不应返还申办者或与其利益相关的第三方。
5.1.5研究者提供处方后才能按照处方剂量领取药物。处方由试验药物管理员统一保存。
5.1.6严格按照试验用药物的储存条件存放,严防污染、变质、损坏。
5.1.7试验用药物的使用记录应包括数量、装运、递送、接受、分配、保管、发放、应用后剩余药物的回收与销毁等方面的信息。
5.1.8机构试验药物管理员应该每天测量温度以保证试验用药物在适宜的温度下保存;机构试验药物管理员每月需对试验用药物的接收、支出及库存进行清点核对。
5.1.9临床试验结束后,机构药品管理员应将剩余的试验用药物退回申办者或者在申办方或见证人在场的情况下进行销毁。
5.2试验药物的准备。
5.2.1临床试验期间,由申办者免费提供试验用药物。
5.2.2如在试验中更换了批号,申办者应提供新批号的药品检验报告后再用于临床试验,研究单位保存新批号的药品检验报告。
5.2.3申办者负责试验用药物的适当包装与标签。
5.2.3.1试验用药物包装应标明试验编号、药物编号、随访号、批号、单位包装数量、剂型、使用说明、保存条件、生产日期、有效期、生产厂家及“临床试验用”字样。
5.2.3.2在设盲的试验中,包装不应该显露药物的身份,应设立一套编码系统,在紧急情况时对个别受试者揭盲以确定产品的身份。
5.2.3.3在设盲的试验中,所有试验用药物,包括参比产品,应该在外形、气味、包装、味道、重量、标签和其他特征上均应一致。
5.2.3.4药物管理员在接收临床试验药物时要对以上要求做严格检查。
5.3试验药物的接收。
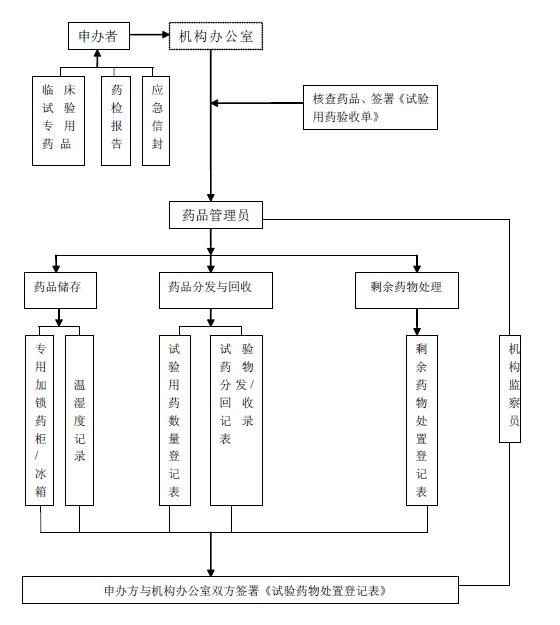
临床监查员将试验用药物送机构试验药物储存室,机构药物管理员负责接收,并遵循以下原则:
5.3.1检查是否与药物临床试验批件相符。
5.3.2检查是否与药品检验报告上的批号一致。
5.3.3检查应急信封是否完整、无破损。
5.3.4药物管理员须确认包装箱内的药物是否与发送单上描述一致,有无缺损,数量是否正确,运送保存是否得当,须低温运输的药物箱内的温度,并立即将试验药物储存在规定的条件下。
5.3.5药物管理员与临床监查员共同签署《临床试验用药物验收单》(附件二),并由双方各自存档或备案。
5.4试验药物的储存。
5.4.1试验用药物由机构药物管理员按照具体要求妥善保管。不得将试验药物销售或进行试验以外的使用。
5.4.2根据临床试验方案的具体要求,必须将试验用药物(包括未用和已回收的)
保存在有锁的药柜内或冰箱内等,所有试验药物(包括未用和已回收的)保存环境须与药物质量要求相符。
5.4.3保存温度:根据申办者的具体要求。若没有具体温度规定可参照《中华人民共和国2010 年版药典》。
5.4.3.1阴凉处:系指不超过20℃。
5.4.3.2凉暗处:系指避光并不超过20℃。
5.4.3.3冷处:系指2-10℃(生物制品除有另外规定外应在2-8℃避光保存)。
5.4.3.4常温:系指l0 — 30℃。
5.4.3.5湿度:45 — 75%。
5.5试验药物的分发与回收。
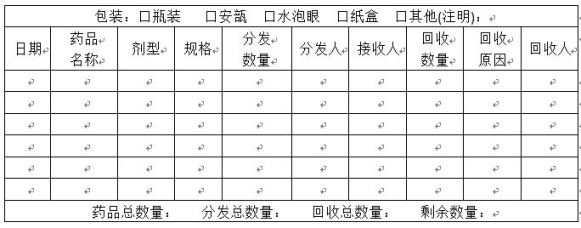
5.5.1试验药物的进出须设详细的收支明细账,由药物管理员填写《试验药物数量登记表》(附件三),保证库存与账目相符,并且便于随时接受检查。
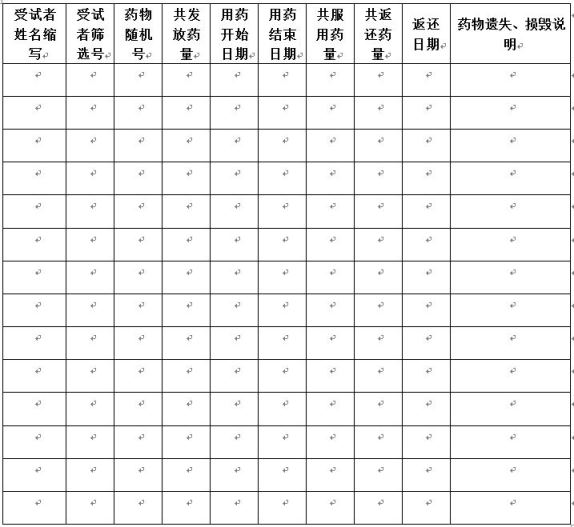
5.5.2每次随访,受试者领用试验用药物时,须由专业药物管理员填写《受试者试验用药物分发/回收登记表》(附件四),后方可领用。该登记表保留在研究者档案中,所有受试者用药情况均应详细记录在该表中。
5.5.3每次随访,受试者归还用完的药物外包装、空容器和未用完的试验用药时,须由专业药物管理员填写《受试者试验用药物分发/回收登记表》(附件四)。
5.5.4申办方和研究者在设计病例报告表时,应考虑能将试验用药的标签贴在病例表上。同时还能记录试验伴随用药及伴随治疗的信息。
5.6剩余药物的处置。
5.6.1通常临床试验均要求受试者归还未使用的试验药物及使用完药物的外包装。
5.6.2对于受试者试验用药的丢失、散落、误用等情况及其相应的解释说明,药物管理员都应在原始资料中详细记录,并评价受试者对临床研究的依从性。
5.6.3临床试验结束时,药物管理员应填写《剩余药物处置登记表》(附件六),将
所有剩余的试验用药及包装容器归还申办者并签署《试验药物处置登记表》(附件七)。如需我方自行销毁,需申办方监查员在场或者见证人在场。
5.7试验药物的核对记录。
5.7.1试验药物的使用记录和实际试验用药的数量应保持一致。所有不一致的情况,药物管理员均应核实并做出说明。
5.7.2如果试验用药物由一个研究单位转至另一个研究单位,记录必须说明数量、日期、运输方法,签字并签署日期。接收的研究单位应记录接收数量、接收时试验用药的状况及接收的方法,签字并签署日期。
5.7.3如试验用药返回申办者再转给另一个研究单位,记录中必须说明原因和申办者对返回的试验用药所做的检查。
5.8钥匙的使用和保管。
5.8.1所有试验药品柜和药品冰箱的钥匙必须由专人统一保管。
5.8.2机构药物管理员保留一套钥匙,专业负责人保留一套钥匙备份。如有多余钥匙必须交由专业负责人保存。
5.8.3钥匙不得随意配制。
5.8.4钥匙如有丢失,试验药物管理员需及时通知机构办公室主任和专业负责人,机构办公室主任应及时采取紧急隔离措施,以保证试验药物的储存安全。
5.8.5药物管理员在使用钥匙后必须及时将钥匙妥善保管,不得暂存于试验药品柜和药品冰箱上。
5.9各种清单。
多数情况下,申办者会提供所有相关记录清单样本。如果没有,则需根据具体情况制定以下五种清单。
5.9.1清单1(临床试验药物验收单):第一部分(表格上方)由申办者方填写。机构药物管理员在检查收到的试验药物后填写验收单的第二部分(表格下方)。验收单一式三份。
5.9.2清单2(试验药物数量登记表):由机构药物管理员填写。
5.9.3清单3(受试者试验药物分发/回收记录表):由专业药物管理员填写。一式两份,原件和病例报告表(CRF)一起由申办者回收。
5.9.4清单4(剩余药物处置登记表)和清单5《试验药物处置登记表》:由机构药物管理员填写。一式两份,原件和病例报告表(CRF)一起由申办者回收。
6附件:
附件一:试验用药管理流程图
附件二:临床试验用药物验收单
附件三:试验药物数量登记表
附件四:受试者试验药物分发/回收记录表
附件五:温度、湿度记录日志
附件六:剩余药物处置登记表
附件七:试验药物处置登记表
附件一:试验用药品管理流程图
附件二:临床试验用药物验收单
临床试验题目:
临床试验方案编号:
试验中心编号:
研究者: 申办者:
试验中心: 试验中心地址:
附件三:试验药物数量登记表
临床试验题目:
临床试验方案编号: 试验中心编号:
研究者: 申办者:
试验中心: 试验中心地址:
附件四:受试者试验物分发/回收记录表(样式,实际使用时纸张改为横向设置)
受试者试验药物分发/回收记录表(专业科室用)
项目名称:
试验专业:
药物名称:剂型:
规格:批号:失效日期:
主要研究者签字:
附件五:温度、湿度记录日志
温度、湿度记录日志
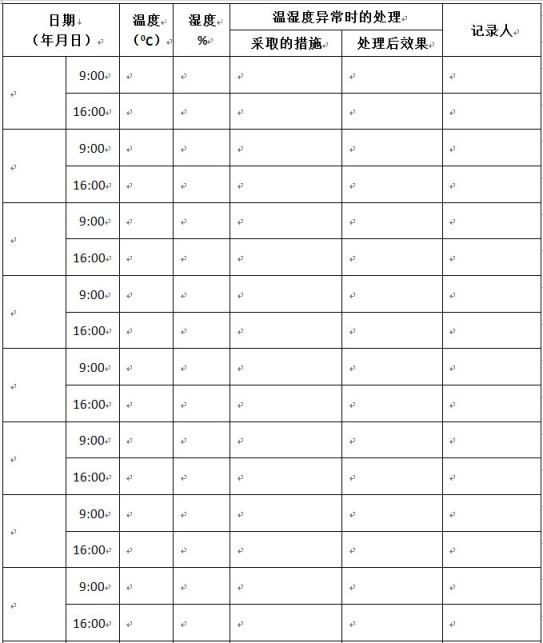
备注:
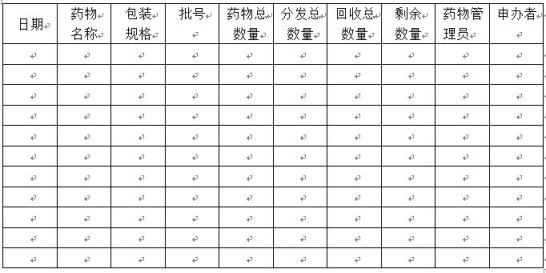
附件六:剩余药物处置登记表
临床试验题目:
临床试验方案编号: 试验中心编号:
研究者: 申办者:
试验中心: 试验中心地址:
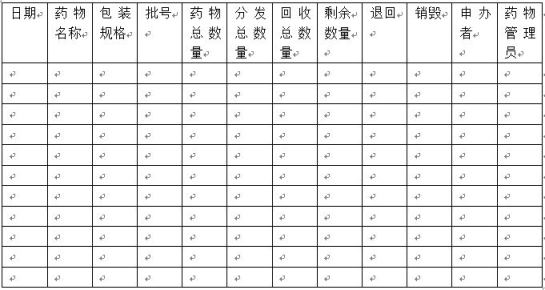
附件七:试验药物处置登记表
试验药物处置登记表
临床试验题目:
临床试验方案编号: 试验中心编号:
研究者: 申办者:
试验中心: 试验中心地址:
上一篇: 药物临床试验机构各级管理人员职责
下一篇:药物临床试验机构资料档案管理制度